Aktualizacja: 17 sierpnia 2022
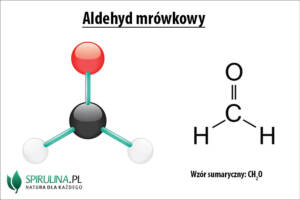 Aldehydy to związki chemiczne należące do organicznych i posiadające grupę aldehydową (karbonylową). Jest ona połączona z 1 lub 2 atomami wodoru. Grupą pokrewnych związków są ketony, nie należy jednak mylić ich z aldehydami. Nie posiadają one bowiem atomu wodoru przy grupie karbonylowej. Aldehydy znajdują szerokie zastosowanie w przemyśle, m.in. do produkcji barwników i tworzyw sztucznych.
Aldehydy to związki chemiczne należące do organicznych i posiadające grupę aldehydową (karbonylową). Jest ona połączona z 1 lub 2 atomami wodoru. Grupą pokrewnych związków są ketony, nie należy jednak mylić ich z aldehydami. Nie posiadają one bowiem atomu wodoru przy grupie karbonylowej. Aldehydy znajdują szerokie zastosowanie w przemyśle, m.in. do produkcji barwników i tworzyw sztucznych.
Spis treści
Nazewnictwo aldehydów
Aldehydy otrzymuje się poprzez odwodornienie alkoholi. W związku z łatwością utleniania się aldehydów do kwasów karboksylowych, nazwy zwyczajowe omawianych związków wprowadza się w zależności od nazw odpowiednich kwasów. Z tą różnicą, że zastępujemy termin „kwas” słowem „aldehyd”. Przykładami aldehydów są więc:
- aldehyd mrówkowy (formaldehyd, metanal);
- aldehyd octowy (acetaldehyd);
- aldehyd propionowy (propanal);
- aldehyd masłowy (butanal).
aldehydów jest wiele, a każdy z nich różni się właściwościami.
Aldehydy – budowa
Aldehydy tworzą szereg homologiczny, w którym każdy kolejny związek różni się od poprzedniego grupą metylenową -CH2-. Atomy węgla grupy karbonylowej znajdują się w stanie hybrydyzacji sp2. W grupie tej występuje wiązanie kowalencyjne silnie spolaryzowane w związku z wysoką różnicą elektroujemności atomu tlenu i atomu węgla. Dodatkowo atom tlenu dysponuje dwiema wolnymi parami elektronowymi. W przypadku aldehydów atom węgla grupy karbonylowej łączy się z jednym atomem wodoru i jednym podstawnikiem węglowodorowym – wyjątkiem jest aldehyd mrówkowy, gdzie grupa karbonylowa łączy się z dwoma atomami wodoru.
Właściwości aldehydów
Aldehydy to bardzo szeroka grupa związków chemicznych. Znajdują się w niej takie, które wykazują toksyczność i nieprzyjemnie pachną, jak również takie, które bywają powszechnie wykorzystywane w kosmetyce, różnych dziedzinach przemysłu, a nawet medycynie. Im krótszy łańcuch węglowy, tym większa toksyczność aldehydu oraz bardziej nieprzyjemny zapach.
Swoje właściwości chemiczne aldehydy zawdzięczają grupie funkcyjnej i reszcie węglowodorowej. Posiadają właściwości redukujące, zaś przykładami reakcji, w których pełnią rolę reduktora, są próby Tollensa i Trommera. W próbie Tollensa odczynnikiem jest amoniakalny roztwór tlenku srebra (I), natomiast w próbie Trommera – jony miedzi w środowisku zasadowym.
Aldehydy posiadające krótkie łańcuchy węglowe wykazują dobrą rozpuszczalność w wodzie, natomiast w miarę wydłużania się łańcuchów węglowych rozpuszczalność szybko maleje.
Aldehydy a ketony
Wiele osób myli aldehydy z ketonami, ponieważ związki te są do siebie bardzo podobne, także pod względem właściwości chemicznych. Niewielka różnica wynika z budowy ketonów, które w przeciwieństwie do aldehydów nie posiadają atomu wodoru przy grupie karbonylowej. Obie grupy związków można odróżnić od siebie dzięki reakcji lustra srebrnego, której ketony nie ulegają. Dodatkowo ketony nie mają skłonności do polimeryzacji, zaś aldehydy już tak.
Aldehydy – zastosowanie
Aldehydy znajdują szerokie zastosowanie. Przykładowo, formaldehyd wykorzystuje się jako surowiec do produkcji barwników, żywic syntetycznych, a także jako preparat dezynfekujący w medycynie. Może służyć do konserwacji i utrwalania preparatów anatomicznych i histopatologicznych. Aldehydy z długimi łańcuchami węglowymi wykazują przyjemny zapach, dlatego są wykorzystywane w branży perfumeryjnej. Mogą mieć zapach cynamonu, gorzkich migdałów, konwalii, bzu czy pomarańczy. Co więcej – jeden aldehyd może łączyć w sobie kilka nut zapachowych, dając niebanalne kompozycje. Przykładowo, w aldehydzie fenylooctowym wyczuwa się jednocześnie aromat różany, bzu i konwalii.
Aldehydy znajdują zastosowanie również w przemyśle gastronomicznym i garbarskim. Z kolei akroleina (najprostszy aldehyd nienasycony) bywa wykorzystywany w kosmetologii, medycynie oraz chemii, jako substrat do reakcji chemicznych. Jest całkowicie nietoksyczny i łatwo biodegradowalny.

 Olej z czarnuszki w kapsułkach 100% naturalny
Olej z czarnuszki w kapsułkach 100% naturalnyCzarnuszka siewna (łac. Nigella sativa) to oryginalny, jakości premium produkt wykazujący wiele właściwości. Wykorzystywany jest m.in. przy zmienionej chorobowo skórze. Działa antygrzybicznie, przeciwwirusowo, antyalergicznie, przeciwwrzodowo, …
Zobacz tutaj ...
Bibliografia
- Graham P., Chemia medyczna, Wydawnictwo PWN, Warszawa 2019.
- Bojarski J., Chemia organiczna, Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków, 2003.







Zostaw komentarz