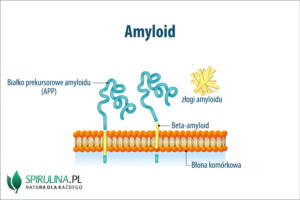
 Amyloid to białko o strukturze włókienkowej składające się z jednego typu białka prekursorowego o charakterystycznej przestrzennej strukturze. Odkłada się w dużej ilości w przestrzeni pozakomórkowej, co jest zjawiskiem patologicznym. Można je zaobserwować np. w przebiegu choroby o nazwie amyloidoza.
Amyloid to białko o strukturze włókienkowej składające się z jednego typu białka prekursorowego o charakterystycznej przestrzennej strukturze. Odkłada się w dużej ilości w przestrzeni pozakomórkowej, co jest zjawiskiem patologicznym. Można je zaobserwować np. w przebiegu choroby o nazwie amyloidoza.
Amyloid – charakterystyka
Amyloid to szkodliwe, nieprawidłowe białko przypominające skrobię. Surowiczy amyloid A (ang. serum amyloid A – SAA) jest białkiem prekursorowym amyloidu A, będącego kluczowym składnikiem depozytów włókienkowych w reaktywnej amyloidozie. Jest to apolipoproteina, która podobnie jak białko C-reaktywne należy do konserwatywnych białek ostrej fazy. Surowiczy amyloid wytwarzany jest przez hepatocyty wątroby, stymulowane przez interleukinę 6, czynnik martwicy nowotworów alfa oraz interleukinę 1. Średnie jego stężenie w populacji osób zdrowych wynosi 3 mg/l, jednak podczas stanów zapalnych może wzrastać nawet do 2000 mg/l.
Fizjologiczna rola surowiczego amyloidu budzi spore kontrowersje w środowisku medycznym. Ewolucyjnie stanowi on element odpowiedzi organizmu na stres czy uraz, a także angażuje się w odzyskanie i ponowną utylizację cholesterolu z uszkodzonych komórek. Jest aktywnie pochłaniany przez makrofagi deponowane w lizosomach i całkowicie rozkładane. U chorych na amyloidozę dochodzi jednak do magazynowania pośrednich produktów degradacji tego białka, które w przestrzeni międzykomórkowej wiążą glikozaminoglikany, surowicze białko P oraz lipidy, co stabilizuje strukturę amyloidu i utrudnia jego proteolizę.
Amyloidoza
Warunkiem powstania amyloidozy jest przewlekły stan zapalny, jednak wyłącznie u części pacjentów z wysokim stężeniem surowiczego amyloidu odkładają się niebezpieczne złogi. Objawy kliniczne zależą od lokalizacji złogów amyloidu. W chwili rozpoznania choroby przeważnie zajętym narządem są nerki. Pojawia się więc proteinuria lub inne zaburzenia funkcji nerek. Aż u 97% pacjentów niemal od początku trwania choroby proteinuria dobowa wynosi ponad 500 mg, a stężenie kreatyniny 1,5 mg/dl i więcej.
Złogi amyloidu mogą także odkładać się w przewodzie pokarmowym. Charakterystyczne objawy to wówczas: wymioty, biegunka, zaburzenia wchłaniania. Złogi amyloidu w naczyniach krwionośnych przewodu pokarmowego zwiększają ich kruchość i mogą prowadzić do groźnych krwawień wewnętrznych. Złogi w wątrobie obserwuje się u 25% pacjentów, zaś zajęcie serca i kardiomiopatia są rzadkością – dotyczą zaledwie 1% chorych.
Do pewnego rozpoznania amyloidozy niezbędne jest wykonanie badania histopatologicznego. Podstawowym testem diagnostycznym pozostaje barwienie czerwienią Kongo, potwierdzające obecność złogów amyloidu. W leczeniu najważniejsza jest kontrola choroby podstawowej. Remisja lub niska jej aktywność wpływają na normalizację parametrów stanu zapalnego, w związku z czym w organizmie nie tworzą się prekursory dla amyloidu. Ponadto trwają badania nad skutecznością leków biologicznych.
Złogi amyloidu – choroby
Choroby, w przebiegu których zaobserwować można odkładanie się złogów amyloidu w tkankach to przede wszystkim: gruźlica, kiła, reumatoidalne zapalenie stawów, przewlekłe zapalenie kości, choroba Creutzfeldta-Jakoba, choroba Parkinsona oraz choroba Alzheimera. Przykładowo w chorobie Alzheimera kumulacja amyloidu w postaci blaszek amyloidowych zakłóca przekaźnictwo sygnału synaptycznego i w konsekwencji tego prowadzi do powstawania wolnych rodników. Poprzez aktywację kinazy ASK1 przyczynia się również do apoptozy. Jednocześnie splątki białka tau blokują wewnątrzkomórkowy transport kluczowy do odżywiania komórki.

 Omega 3 – czysty roślinny olej z Pachnotki zwyczajnej
Omega 3 – czysty roślinny olej z Pachnotki zwyczajnejOmega 3 to naturalny produkt zawierający w swoim składzie czysty, roślinny olej, z pełniącymi istotną rolę w odżywianiu człowieka kwasami tłuszczowymi Omega 3. Stanowi wsparcie dla mózgu i odpowiada za jego prawidłową pracę. Dodatkowo wspiera odporność
Zobacz tutaj ...
Bibliografia
- Więsik-Szewczyk E., Amyloidoza AA – przyczyny, diagnostyka, opcje terapeutyczne, Hematologia, 3/2018.
- Lis-Święty A., Widuchowska M., Wcisło-Dziadecka D., Brzezińska-Wcisło L., Kucharz E., Surowiczy amyloid A – białko ostrej fazy związane z patogenezą twardziny układowej?, Przegląd Dermatologiczny, 99/2012.
- Bugaj A., Jermakow N., Mechanizmy leżące u podłoża choroby Alzheimera, Neuropsychiatria i Neuropsychologia, 11/2016.






Zostaw komentarz